Niels Bohr diede inizio alla sua ricerca sui quanti quando nel 1912 andò a lavorare a Manchester assieme al neozelandese Ernest Rutherford, uno degli scienziati più importanti della sua epoca, che aveva vinto nel 1908 il Nobel per la chimica, nonostante egli fosse un fisico. Bohr giunse nel periodo in cui Rutherford propose il suo modello atomico: l’atomo è una particella grande appena un decimilionesimo di millimetro (10-7 mm), che a sua volta possiede una struttura interna costituita da un nucleo, con dimensioni diecimila volte più piccole del diametro dell’atomo (10-12 mm), il quale contiene praticamente tutta la sua massa; attorno al nucleo si trovano delle particelle leggerissime in continuo movimento dette elettroni con massa quasi nulla. Una volta compresa la struttura del modello atomico di Rutherford, Bohr si addentrò per un’impervia ed affascinante ricerca che lo avrebbe impegnato per mezzo secolo, alla scoperta dell’essenza dei fenomeni quantistici.
Bohr, anziché partire da ciò che era teoricamente “noto” sulla struttura dell’atomo, approfondì i dati spettroscopici ed ipotizzò che gli elettroni ruotassero attorno al nucleo di un atomo in orbite, o strati, che stanno a distanze ben precise dal nucleo. Ciascuno di questi strati può contenere soltanto fino a un certo numero di elettroni e qualora l’atomo abbia più elettroni di quanti il primo strato possa contenere, essi riempiono il secondo strato; se l’atomo ha più elettroni di quanti il primo ed il secondo strato combinati possano contenere, comincerà a riempirsi il terzo strato, e così via.
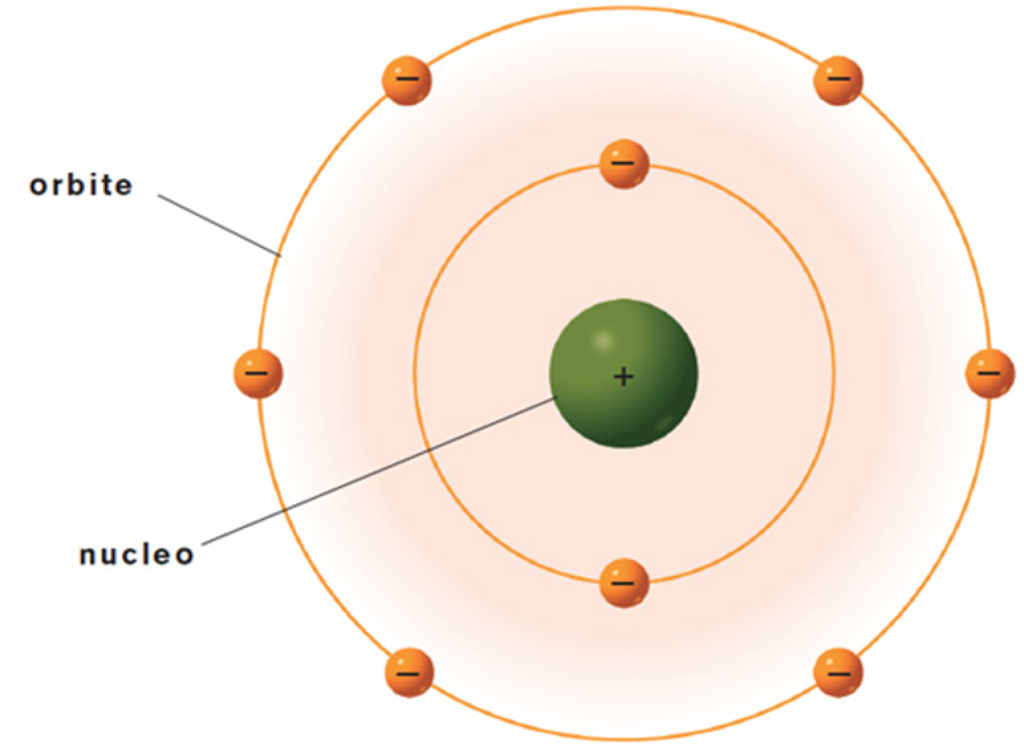
Modello atomico di Rutherford
Rutherford suggerì un modello dell’atomo in cui gli elettroni si trovano fuori dal nucleo, ad una distanza migliaia di volte più grande del raggio del nucleo stesso: se immaginiamo di poter ingrandire di miliardi di volte la dimensione di un atomo, arrivando a far diventare il nucleo grande quanto una mela, l’elettrone sarebbe all’incirca delle dimensioni di una ciliegia che gli ruoterebbe intorno con un raggio di 250 km! E cosa ci sarebbe nello spazio tra la ciliegia e la mela? Il vuoto, energia senza materia. L’atomo è per il 99,999% vuoto. Quest’immagine fece sorgere la questione della stabilità dell’atomo. Per prima cosa, i fisici erano certi che gli elettroni fossero tutt’altro che in stato di quiete negli atomi, in quanto la forza elettrica esercitata dal nucleo positivo avrebbe risucchiato gli elettroni negativi verso di esso. La soluzione più semplice sarebbe quindi stata considerare il modello planetario, in cui gli elettroni sono in orbita continua attorno al nucleo, così come la Terra orbita intorno al Sole evitando di precipitare su di esso a causa dell’attrazione gravitazionale.
Bohr però era preoccupato di una differenza cruciale – a parte, ovviamente, quella delle dimensioni – tra un atomo e il sistema solare: secondo la teoria elettromagnetica classica, un elettrone in orbita deve irradiare luce e di conseguenza, dovrebbe gradualmente perdere energia e scendere a spirale verso il nucleo. Questo processo dovrebbe accadere molto in fretta (circa un millesimo di miliardesimo di secondo), con conseguente collasso degli atomi. Benché a posteriori la soluzione di Bohr possa sembrare ovvia, al tempo si rivelò assolutamente rivoluzionaria. Egli ipotizzò che se tutta la materia rilascia radiazioni in pacchetti di energia o quanti (poi denominati fotoni), e la assorbe in pacchetti – come dimostrato da Albert Einstein con l’effetto fotoelettrico – allora, forse, gli atomi che costituiscono la materia possono semplicemente avere solo precisi livelli di energia, escludendo valori intermedi di energia tra un blocco e l’altro.
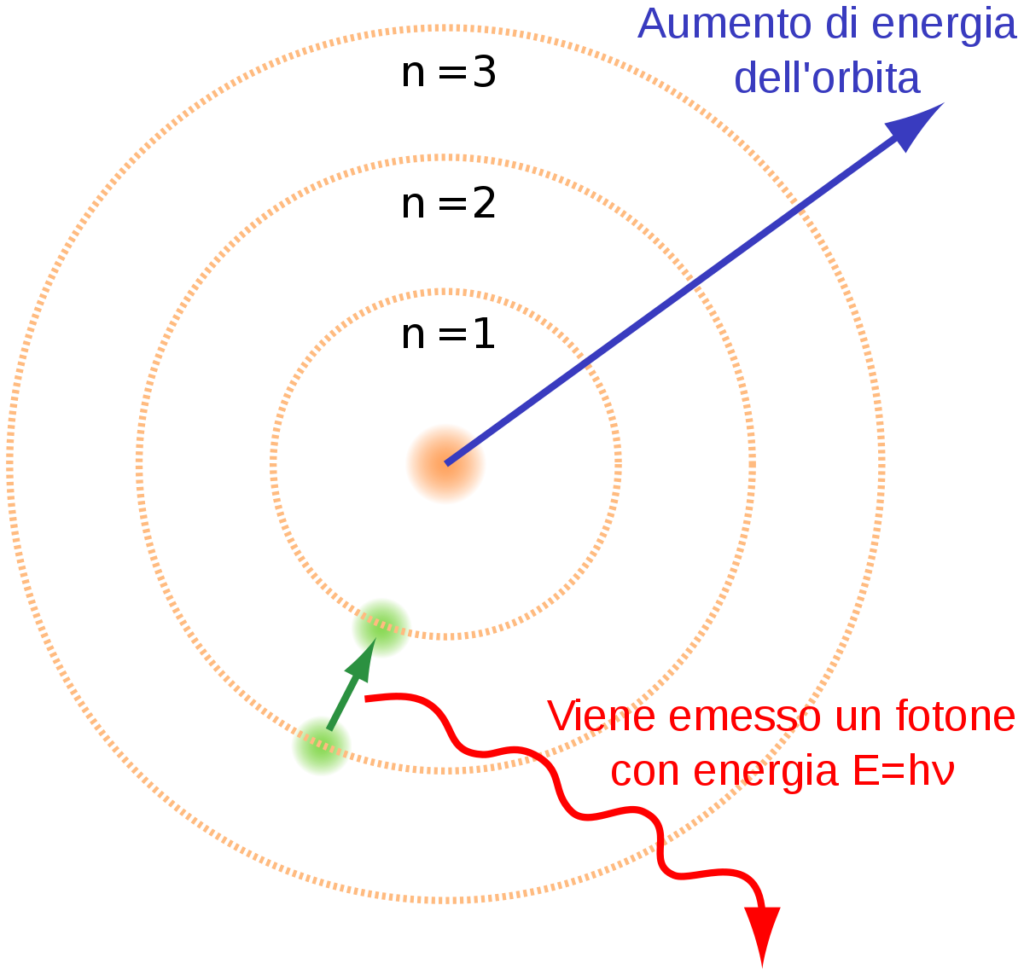
Modello atomico di Bohr
Bohr postulò quindi che l’energia degli elettroni nell’atomo risulta essa stessa quantizzata, ovvero agli elettroni è impedito percorrere una qualunque orbita, come le leggi di Newton vorrebbero, ma solamente certe orbite «discrete», come se esistessero dei binari concentrici: un treno sta o su un binario o sull’altro, stare nel mezzo è impossibile. Un elettrone può cadere su un’orbita più bassa (cioè più vicina al nucleo) emettendo un quanto di energia elettromagnetica (un fotone). Nello stesso modo l’elettrone può saltare su un’orbita più alta solo assorbendo un fotone.
La stabilità dell’atomo fu spiegata più dettagliatamente da un giovane genio tedesco di nome Wolfgang Pauli, che dimostrò come ogni orbita elettronica può accomodare solo un certo numero di elettroni. Gli elettroni possono cadere su un’orbita più bassa solo se c’è un posto disponibile. Vedremo in seguito che gli elettroni sono da considerare in maniera diversa da piccoli granelli che girano attorno al nucleo, ma piuttosto dovremo considerarli come onde, e ogni «onda elettromagnetica» si estende tutt’attorno al nucleo.
Bohr quindi assume che gli elettroni possano vivere solo a certe distanze “speciali” dal nucleo, ovvero solo su certe particolari orbite la cui distanza è determinata dalla costante di Planck[1], e possano saltare fra l’una e l’altra delle orbite atomiche: sono i famosi salti quantici. Gli spettri degli elementi sono un insieme di righine colorate di diversi colori, in cui si scompone (come in un prisma) la luce emessa da una sostanza data e Bohr, attraverso queste due assunzioni, riesce a calcolare gli spettri di tutti gli atomi e addirittura a prevedere correttamente spettri ancora da osservare. Il successo sperimentale di questo semplice modello fu davvero sorprendente, nonostante andasse in direzione opposta a tutte le idee del tempo sulla materia e sulla dinamica. Ma perché solo certe orbite? E che cosa significa che gli elettroni “saltano”?
Nel suo Istituto di Fisica di Copenaghen, Bohr raccolse alcune delle giovani menti più brillanti del secolo per cercare di mettere un po’ d’ordine nel groviglio di comportamenti perlopiù incomprensibili del mondo atomico e provare a costruire una teoria coerente. La ricerca fu lunga e faticosa, ma un giovanissimo tedesco trovò la chiave per risolvere questo mistero: Werner Heisenberg.
Heisenberg aveva solo venticinque anni quando, per primo, scrisse le equazioni della meccanica quantistica, e lo fece basandosi su un’intuizione che gli venne una notte, nel parco dietro l’Istituto di Fisica di Copenaghen. Era il 1925 ed il giovane passeggiava pensieroso nel parco perlopiù buio, che aveva solo qualche sporadico lampione che illuminava con un piccolo cono di luce fioca qui e là. I coni di luce erano separati da larghi spazi di oscurità. Ad un tratto Heisenberg vide passare un uomo. In realtà ciò è un’imprecisione: l’uomo appariva sotto ad un lampione, poi scompariva nel buio per riapparire, poco dopo, sotto un altro lampione, e quindi scomparire di nuovo nel buio, e così via, di cono di luce in cono di luce, fino a scomparire del tutto nella notte. Heisenberg «ovviamente» sapeva che l’uomo era incapace di scomparire e riapparire davvero, e intuì come con il pensiero si potesse ricostruire la reale traiettoria dell’uomo fra un lampione e l’altro.
Gli oggetti macroscopici sono incapaci di scomparire e riapparire… ma gli elettroni? Questa fu la folgorazione di Heisenberg: se questo «ovviamente» fosse invalidato per gli oggetti microscopici come gli elettroni? se un elettrone avesse effettivamente la proprietà di scomparire e riapparire? se fossero questi i misteriosi salti quantici da un’orbita all’altra a far tornare i conti degli spettri? se un elettrone fosse qualcosa che si manifesta solo quando interagisce con qualcos’altro e fra un’interazione e l’altra fosse, letteralmente, in nessun luogo?
Heisenberg tornò a casa e si tuffò nei calcoli, riemergendo qualche tempo dopo con una teoria sconcertante: una descrizione fondamentale del movimento delle particelle in cui queste, invece che essere descritte per mezzo della loro posizione a ogni momento, lo sono solo attraverso la loro posizione in certi istanti ovvero gli istanti in cui interagiscono con qualcos’altro. Inoltre capì che quanto meglio conosciamo la posizione dell’elettrone, tanto più incerta diventa la quantità di moto, e viceversa. Si può decidere di effettuare una misurazione precisa di una delle due quantità, ma così facendo resteremo completamente all’oscuro dell’altra.
 Con questa teoria venne definita una pietra della meccanica quantistica, la chiave più difficile: l’aspetto relazionale di tutte le cose. È sbagliato quindi affermare che gli elettroni esistono sempre, ma esistono solo quando interagiscono, materializzandosi in un luogo quando sbattono contro qualcos’altro. I salti quantici da un’orbita all’altra sono quindi il loro modo di essere reali: un elettrone è un insieme di salti da un’interazione all’altra mentre quando nessuno lo disturba, un elettrone si trova in nessun luogo. È importante comprendere e tenere bene a mente che questa è tutt’altro che un’imperfezione dovuta alle tecniche con cui viene fatta la misurazione, ma è una limitazione di principio.
Con questa teoria venne definita una pietra della meccanica quantistica, la chiave più difficile: l’aspetto relazionale di tutte le cose. È sbagliato quindi affermare che gli elettroni esistono sempre, ma esistono solo quando interagiscono, materializzandosi in un luogo quando sbattono contro qualcos’altro. I salti quantici da un’orbita all’altra sono quindi il loro modo di essere reali: un elettrone è un insieme di salti da un’interazione all’altra mentre quando nessuno lo disturba, un elettrone si trova in nessun luogo. È importante comprendere e tenere bene a mente che questa è tutt’altro che un’imperfezione dovuta alle tecniche con cui viene fatta la misurazione, ma è una limitazione di principio.
La forma matematica precisa della relazione tra queste incertezze nella posizione e nella quantità di moto di una particella divenne nota come Principio di indeterminazione di Heisenberg, la cui importanza fondamentale consiste nel fatto che esso esprime i limiti dei nostri concetti classici.
NOTE:
[1] Una costante fisica che rappresenta l’azione minima possibile e determina che l’energia e le grandezze fisiche fondamentali ad essa legate evolvano in modo discontinuo, cioè siano quantizzate, ovvero possano assumere solo valori multipli di tale costante.
BIBLIOGRAFIA:
- Al-Khalili, Jim. 2003. Quantum. A Guide for the Perplexed. London : Weidenfeld & Nicolson Ltd., 2003. Trad. it. La fisica dei perplessi. L’incredibile mondo dei quanti. Torino : Bollati Boringhieri, 2014.
- Capra, Fritjof. 1975. The Tao of Physics. Boulder : Shambhala Publications, 1975. Trad. it. Il Tao della fisica. Milano : Adelphi edizioni S.p.A., 1982.
- Lavalle, Mauro. 2019. Fisica quantistica, fisica della vita. Viaggio alla scoperta della struttura della materia, della Biologia e della Psicologia Quantistica. Romagnano al Monte (SA) : BookSprint Edizioni, 2019.
- Rovelli, Carlo. 2014. La realtà non è come appare. La struttura elementare delle cose. Milano : Raffaello Cortina editore, 2014.
- Scolari, Fabio. 2019. Psicologia quantistica. Valutazione critica della sua possibile applicazione in ambito lavorativo. 2019.
- Zukav, Gary. 1979, 2001. The dancing Wu Li Masters. New York : William Morrow and Company, 1979, 2001. Trad. It. La danza dei Maestri Wu Li. La fisica quantistica e la teoria della relatività spiegate senza l’aiuto della matematica. Milano : Garzanti S.r.l., 2015.